MATERI DAN PERUBAHANNYA
I. Materi
Materi adalah segala sesuatu yang
mempunyai massa dan menempati ruang (mempunyai volume).
Materi terdapat dalam tiga macam
wujud : padat (solid), cair (liquid), dan gas.
Massa tidak sama dengan
berat.
Massa adalah ukuran
kelembaman, yaitu ukuran bertahannya suatu benda terhadap suatu gaya, massa
tidak tergantung pada gaya grafitasi suatu tenpat.
Berat adalah gaya
yang menyatakan besarnya tarikan gravitasi terhadap benda yang bermasssa. Berat
suatu benda sangat bergantung kepada gravitasi.
Sifat-sifat suatu materi dapat
dikelompokkan menjadi sifat ekstensif dan sifat intensif yaitu :
1. Sifat ekstensif
ialah sifat yang bergantung pada bentuk, ukuran dan jumlah zat.
Contoh : Massa dan volume
2. Sifat
intensif ialah sifat yang tidak ditentukan oleh bentuk, ukuran dan
jumlah zat.
Contoh : Cincin dan gelang yang
sama-sama terbuat dari emas akan memperlihatkan sifat intensif yang sama
: warnanya kuning mengkilap tidak berkarat dan memiliki berat jenis yang
tertentu.
Sifat intensif suatu materi
dapat dikelompokkan :
a. Sifat fisis, yaitu Sifat yang
tidak berhubungan dengan pembentukan zat baru.
Contoh : warna, rasa,
bau, titik lebur, titik didih, kekerasan, kerapatan, dan berat jenis.
b. Sifat kimia
erat hubungannya dengan pembentukan zat baru.
Contoh : sifat terbakar dari kayu,
sifat berkaratnya besi masamnya susu
II. Perubahan
materi
dapat digolongkan menjadi dua
macam, yaitu :Perubahan fisika dan Perubahan kimia
A. Perubahan fisika
Perubahan fisika adalah perubahan materi/zat yang tidak disertai terjadinya zat baru, tidak berubah zat asalnya, hanya terjadi perubahan wujud, perubahan bentuk atau perubahan ukuran.
Contoh : air membeku menjadi
es.
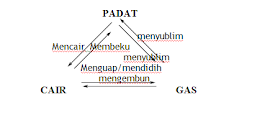
a. Perubahan
fisika karena perubahan wujud.
Perubahan wujud dapat
digambarkan sebagai berikut :
b. Perubahan
fisika karena perubahan bentuk
Contoh : beras diubah menjadi tepung
beras, kayu diubah menjadi kursi atau lemari, kain diubah menjadi baju dll
c. Perubahan
fisika karena pelarutan atau pengeringan.
Contoh : gula diubah menjadi
sirup, nasi diubah menjadi bubur, sayuran menjadi layu, air laut diubah
menjadi garam, cabe segar diubah menjadi kering.
d. contoh lain perubahan fisika
yaitu : bola lampu listrik menyala, cermin memantulkan sinar, mobil di cat, dll
.
B. Perubahan Kimia
Perubahan kimia adalah perubahan zat yang menyebabkan
terjadinya satu atau lebih zat yang jenisnya baru. Perubahan kimia disebut juga
reaksi kimia. Jadi bereaksi berarti berubah menjadi. Zat yang bereaksi disebut
pereaksi (reaktan) dan hasil reaksi disebut produk.
a. perubahan kimia karena proses pembakaran.
Pada proses pembakaran terjadi
reaksi antara zat yang terbakar dengan oksigen dan api. Pada roses ini selalu
dibebaskan energi dari reaksi tersebut. Makanya pada proses pembakaran
akan terasa adanya panas. Pada proses pembakaran, zat asal akan berubah menjadi
zat baru yang berbeda sifatnya dari zat asal. Kertas dibakar akan berubah
menjadi gas, asap ataupun abu. Contoh proses pembakaran : lilin menyala, mercon
meledak, bensin terbakar (energi yang dihasilkan digunakan untuk menggerakkan
mobil).
b. Proses kimia karena proses peragian.
Proses peragian terjadi di mana zat
asal yang mengandung karbohidrat protein dengan bantuan mikroorganisme
(ragi/bakteri) akan berubah menjadi zat-zat lain. Contohnya : kedelai diubah
menjadi tempe, kecap tauco; singkong atau beras diubah menjadi tape; singkong
diubah menjadi gula cair(glukosa); gandum diubah menjadi bir; dll.
c. Perubahan kimia karena proses kerusakan
Kerusakan terjadi karena kimia,
mikroba enzimatis. Contohnya: pelapukan kayu; makanan basi ; besi berkarat;
minyak menjadi tengik;apel setelah dikupas menjadi coklat dll.
d. Perubahan kimia dari proses makhluk hidup.
Meliputi: proses pencernaan
makanan; proses pernafasan; proses fotosintesis dll.
Perubahan kimia pasti terjadi dari
suatu hasil reaksi kimia. Berlangsungnya suatu reaksi kimia dapat diketahui
dengan: timbulnya gas, timbulnya endapan, terjadinya perubahan warna dan
terjadinya perubahan suhu.
1.
Reaksi yang menghasilkan gas
Besi + Larutan H2SO4 : menghasilkan
gas hidrogen
2.
Reaksi yang menghasilkan endapan
Larutan timbal (II) asetat +
larutan kalium iodida : menghasilkan endapan kuning
3.
Reaksi yang disertai perubahan warna
Larutan kalium kromat yang berwarna
(kuning) akan menjadi jingga jika di tetes dengan larutan asam sulfat
4.
Reaksi yang disertai perubahan suhu
Reaksi antara kapur tohor dengan
air menyebabkan kenaikan suhu
III. Energi
Energi adalah kemampuan untuk
melakukan kerja. Energi tidak mempunyai massa dan tidak menempati ruang. Energi
hanya dapat diukur berdasarkan efek atau pengaruhnya terhadap materi. Makin
besar pengaruh tersebut makin besar pula jumlah energi. Contoh dinamit
menyebabkan kerusakan yang lebih hebat daripada petasan.
Setiap zat mengandung energi, maka
setiap reaksi kimia selalu disertai perubahan
energi.
Sehubungan dengan hal ini, dikenal
dua macam reaksi kimia yaitu :
a. Reaksi
eksoterm, yaitu reaksi yang menghasilkan (melepaskan) energi. Contoh pembakaran
kayu atau minyak tanah untuk memperoleh panas dan pembakaran kembang api untuk
menghasilkan cahaya berwarna warni.
b. Reaksi
endoterm, yaitu reaksi yang memerlukan (menyerap energi). Contoh fotosintesis
tumbuhan yang memerlukan energi sinar matahari dan pembentukan gambar fotografi
melalui penyerapan cahaya oleh zat-zat yang terdapat pada film.
IV. Korosi
Logam yang
dibuat untuk tujuan komersial biasanya tidaklah murni, besi atau baja misalnya,
banyak bercampur karbon. Zat-zat pengotor (impurities) ini tidak tersebar
merata dalam logam; melainkan bertumpuk pada bagian-bagian tertentu akibatnya
timbul perbedaan potensial listrik antara bagian tersebut dengan bagian
permukaan yang normal (tidak mengandung zat-zat campuran). Bagian
permukaan yang mengandung zat pengotor lebih mudah menangkap electron atau
melepaskan electron sehingga dapat berfungsi sebagai katode atau
anode. Ketika logam bertemu uap air di udara, pada permukaan terbentuk
lapisan air. Oksida asam di udara dapat larut dalam lapisan air tersebut
, dan terbentuklah larutan asam pada permukaan logam. Dengan
demikian tersedia “ sel volta”, anode, katode dan larutan elektrolit , maka
secara spontan reaksi redoks berlangsung. Pada reaksi redoks ini
terbentuk Fe2O3 xH2O (inilah yang merupakan karat besi).
Faktor-faktor yang mempengaruhi
korosi
1. adanya oksigen
dan air
2. pH larutan
3. garam-garam
4. kontak logam
tersebut dengan logam lain.
Kerugian korosi.
Korosi menyebabkan besi dan
logam-logam lain menjasi lapuk, sehingga keropos dan menjadi rusak.
Cara memperlambat korosi.
1. Pada pembuatan
logam diusahakan agar zat-zat yang dicampurkan (impurities) tersebar secara
merata (homogen) dalam logam tersebut.
2. melapisi permukaan
dengan cat atau minyak untuk mencegah kontak antara permukaan logam dengan
udara.
3. melakukan
galvanisasi (penyalutan) misalnya besi disalut dengan lapisan tipis seng.
Seng memiliki Eo yang lebih kecil dari pada besi sehinga seng
segera teroksidasi membentuk lapisan ZnO yang melindungi permukaan besi.
4. mengorbankan
anode untuk melindungi katode.
Dalam reaksi kimia, tidak terjadi perubahan massa antara zat sebelum dan
sesudah reaksi. Hal ini yang dikemukakan oleh Lavoisier yang dikenal
dengan hukum kekekalan massa (Hk Lavoisier) yang berbunyi :’’massa zat sebelum
dan massa zat sesudah reaksi adalah sama’’.
Contohnya pada pembakaran . pada pembakaran kertas/kayu hasil reaksi pembakaran
seolah-olah massanya berkurang karena kita hanya mendapatkan abu yang jumlahnya
sedikit dari sisa pembakaran. Hal ini tidak benar, karena adanya asap dan
gas-gas lain yang tidak terlihat dan bercampur dengan udara massanya
tidak diperhitungkan. Jika kita hitung massa asap dan gas-gas hasil reaksi maka
akan diperoleh :
Massa kayu/kertas + massa oksigen =
massa abu + asap + massa gas.
Begitu juga dengan proses
perkaratan besi (korosi), seolah massanya bertambah dibanding massa bes. Hal
ini tidak benar, karena gas oksigen yang bereaksi dengan besi tidak
diperhitungkan. Jika oksigen diperhitungkan maka:
Massa besi + massa oksigen = massa
karat
MATERI BAB SELANJUTNYA
Sumber:
KIMIA untuk SMA kelas X, Unggul Sudarmo, Penerbit Erlangga, 2004
KIMIA 1 SMU, untuk Kelas 1, Irfan Anshori dan Hiskia Ahmad, Penerbit Erlangga, 1999
KIMIA untuk SMA/MA, kelas X, Tarti Harjani, dkk, Penerbit Masmedia, 2012




Tidak ada komentar:
Posting Komentar